Se sei un Fabbricante di Dispositivi Medici dotati di certificato valido rilasciato da un Organismo Notificato ai sensi della Direttiva 90/385/CEE (AIMDD) o della Direttiva 93/42/CEE (MDD), puoi immettere i tuoi dispositivi sul mercato anche in seguito al 26 maggio 2021 (data di piena applicazione dell’MDR (UE) 2017/745) e non oltre il 27 maggio 2024.
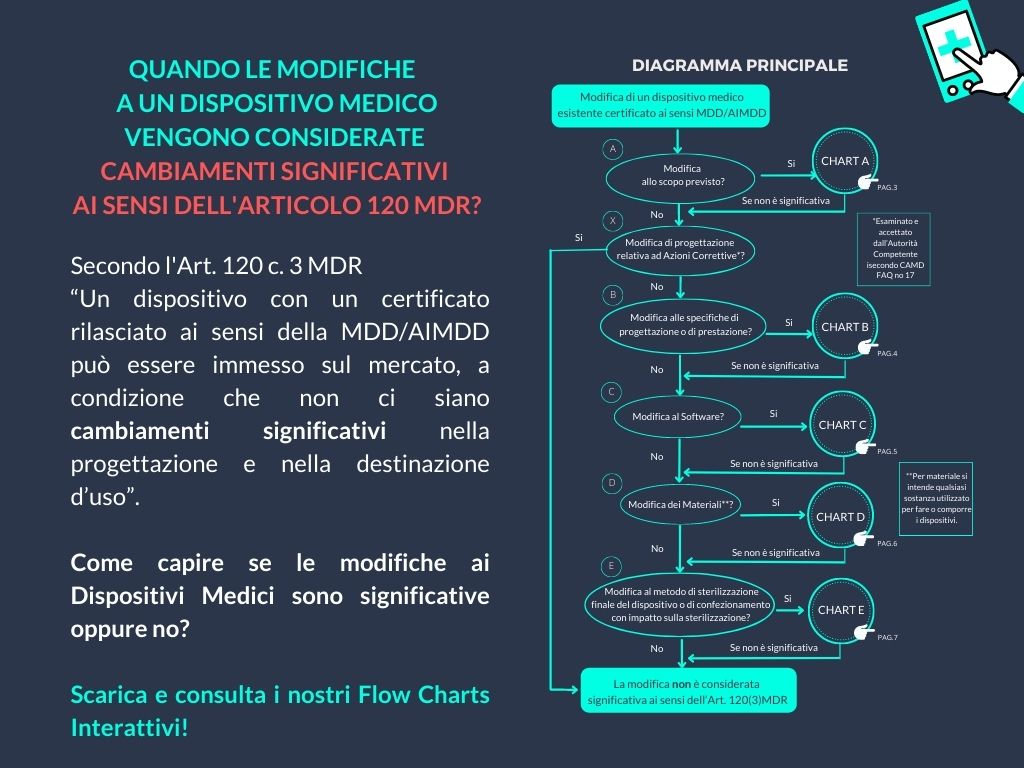
Ma, così come definito dall’Art. 120 c. 3 MDR, “Un dispositivo con un certificato rilasciato ai sensi della MDD/AIMDD può essere immesso sul mercato, a condizione che non ci siano cambiamenti significativi nella progettazione e nella destinazione d’uso”.
Come devi comportarti in caso di modifiche al tuo Dispositivo Medico?
Ti dovrai interrogare per capire se è una modifica significativa nel design e nello scopo del Dispositivo Medico da comunicare all’Organismo Notificato (rif. Doc. NBOG PBG 2014 – 03).
Se la modifica non è significativa (cambiamento non significativo), il Certificato CE MDD/AIMDD rimane valido.
Se la modifica è significativa (cambiamento significativo) da comunicare all’Organismo Notificato (ON) e determina la fine della validità del Certificato CE, il Certificato CE MDD/AIMDD perde di validità. Se invece la modifica è significativa da comunicare all’ON ma l’ON approva la modifica, il Certificato CE rimane valido.
Se la modifica non è significativa ai sensi dell’Art.120 MDR potrebbe esserla per l’NBOG PBG 2014 – 03 “Guidance for manufacturers and Notified Bodies on reporting of Design Changes and Changes of the Quality System”, pertanto la modifica potrebbe comunque dover essere riportata all’ON.
Come capire se le modifiche ai Dispositivi Medici sono significative oppure no?
Per aiutarti a capire se una modifica può essere considerata significativa o meno nella progettazione o nella destinazione d’uso del dispositivo ai sensi dell’Articolo 120, c. 3 MDR, facciamo riferimento alla linea guida MDCG 2020-3 “Guidance on significant changes regarding the transitional provision under Article 120 of the MDR with regard to devices covered by certificates according to MDD or AIMDD“.
Nel documento presentiamo i relativi 6 Flow Charts Interattivi, suddivisi in 1 diagramma principale e in 5 diagrammi secondari:
- Chart A – Modifiche allo scopo previsto.
- Chart B – Modifiche alle Specifiche di Progettazione o di Prestazione.
- Chart C – Modifiche al Software.
- Chart D – Modifiche dei Materiali.
- Chart E – Modifiche al metodo di sterilizzazione finale del dispositivo o di confezionamento con impatto sulla sterilizzazione.
La risposta a una serie di domande utili ti aiuterà a determinare se una modifica può essere considerata significativa oppure no.
La modifica è considerata non significativa rispetto alla progettazione o alla destinazione d’uso ai sensi dell’Art. 120 MDR, qualora la risposta a ogni domanda prevista dai diagrammi secondari conduca al risultato «cambiamento non significativo», anche tornando al diagramma principale.
Fonte:
Scarica e consulta i nostri Flow Charts Interattivi!
Compila il Form e scopri se la modifica ai tuoi Dispositivi Medici è un cambiamento significativo ai sensi dell’Art. 120 MDR!




