Il 24 marzo 2025 segna una tappa fondamentale per il settore dei Dispositivi Medici in Australia: in questa data è ufficialmente entrato in vigore il sistema di Identificazione Unica dei Dispositivi Medici (UDI), come stabilito dal Therapeutic Goods Legislation Amendment (Australian Unique Device Identification Database and Other Measures) Regulations 2025. Con l’introduzione dell’UDI, l’Australia rafforza il proprio quadro regolatorio, allineandosi agli standard internazionali.
Questo cambiamento è destinato ad avere un impatto positivo rilevante sulla tracciabilità, sulla sicurezza e sulla gestione post-commercializzazione dei Dispositivi Medici.
In questa fase iniziale, il sistema UDI per Dispositivi Medici in Australia è disponibile su base volontaria. In altre parole, sponsor e fabbricanti possono già registrarsi e caricare i dati nel database nazionale, l’Australian Unique Device Identification Database (AusUDID), gestito dalla Therapeutic Goods Administration (TGA).
L’introduzione dei requisiti obbligatori per l’etichettatura dei Dispositivi Medici sarà invece graduale. Il primo appuntamento con le scadenze è fissato per il 1° luglio 2026: a partire da questa data gli sponsor e i fabbricanti che distribuiscono la maggior parte dei Dispositivi Medici in Australia dovranno obbligatoriamente apporre l’UDI sull’etichetta del dispositivo e su tutte le confezioni pertinenti, oltre a inviare i dati all’AusUDID.
Requisiti UDI
TGA ha modificato i principi essenziali dell’Allegato 1 del Therapeutic Goods (Medical Devices) Regulations 2002 per integrare definire i requisiti UDI. Similmente ad altri Paesi, il sistema UDI australiano prevede:
- Assegnazione di un codice UDI (UDI-DI e UDI-PI) per ciascun dispositivo medico.
- Registrazione dei dati UDI nel database AusUDID;
- Inserimento del codice UDI sull’etichetta e sulle confezioni
- Marcatura diretta (Direct Marking) per alcuni dispositivi riutilizzabili.
Inoltre, è previsto l’uso di due formati complementari:
- HRI (interpretazione leggibile dall’uomo)
- AIDC (acquisizione automatica dei dati)
Grazie a questa doppia modalità, la tracciabilità viene garantita sia manualmente che con sistemi automatizzati, lungo tutta la supply chain.
Implementazione graduale: scadenze per i Dispositivi Medici
L’obbligatorietà dell’UDI seguirà una tempistica scaglionata in base alla classificazione del rischio del prodotto.
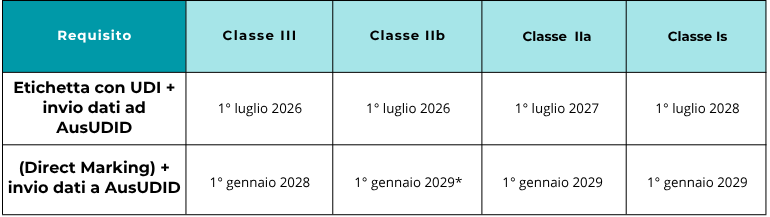
La marcatura diretta per i dispositivi di Classe IIb può essere soggetta a eccezioni specifiche indicate dalla TGA.
Invio dei dati UDI al database TGA
L’introduzione del sistema UDI in Australia si inserisce in un più ampio processo di armonizzazione globale, che coinvolge sempre più Paesi nel settore dei Dispositivi Medici. L’obiettivo è quello di rendere più efficace e trasparente l’intero ciclo di vita del dispositivo, a partire dalla sua tracciabilità, elemento chiave per una gestione responsabile e sicura. Allo stesso tempo, il sistema UDI contribuisce a rafforzare la sicurezza del paziente, facilitando interventi rapidi in caso di problemi, come richiami o avvisi di sicurezza e supportando un monitoraggio post-commercializzazione più strutturato e tempestivo.
In questo contesto, è fondamentale che sponsor e fabbricanti inizino a prepararsi fin da subito. Definire un piano di adeguamento graduale, aggiornare le procedure interne e acquisire dimestichezza con il funzionamento del database AusUDID sono passi necessari per garantire una transizione fluida e la piena conformità ai requisiti normativi australiani.
>>> Thema offre il supporto completo e personalizzato per la registrazione dei Dispositivi Medici in Australia, inclusa la conformità al sistema UDI. I consulenti Thema ti guideranno in ogni fase del processo, garantendoti una transizione fluida e il rispetto della regolamentazione australiana.
FONTI:
16/06/2025




