Las inspecciones de la FDA siempre son una experiencia muy interesante: por un lado muy estresantes, por supuesto, pero por otro lado siempre dejan esa sensación mágica de haber aprendido algo más, no solo en el trabajo, sino también un poco sobre la vida. Por ejemplo, el año pasado uno de los muchos inspectores ha generado en mi una inquietud con una declaración bastante simple: «Si no se gestionan las CAPAs (Acciones correctivas y Acciones preventivas), significa que el sistema está muerto». S i lo pensamos bien, es cierto: solo corrigiendo y previniendo problemas puedes mejorar la efectividad del sistema permitiendo la evolución de la organización. Si no se hace nada, el sistema sigue siendo ficticio y, al punto de considerarlo un sistema muerto. Con respecto a las CAPAs, refiérese a los capítulos 8.5.2 y 8.5.3 de EN ISO 13485:2016: 2016 pero también a 21 CFR 820.100 Acción correctiva y preventiva.
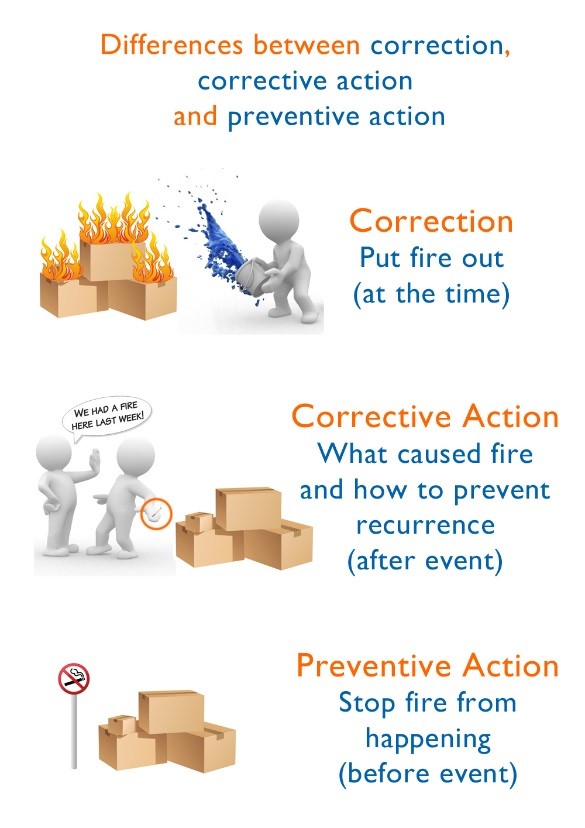
En primer lugar, una Acción Correctiva no es la acción que resuelve la no conformidad, este es uno de los malentendidos más comunes. «Detecté esta no conformidad y la resolví con esta acción correctiva» es una de las frases más equivocadas. La acción a tomar para resolver una no conformidad es la Corrección. La Acción Correctiva es la acción tomada simultáneamente con la no conformidad o una vez que se haya resuelto, para evitar su recurrencia en el futuro. Mientras que la Acción Preventiva previene la ocurrencia de cualquier no conformidad que aún no ha ocurrido (o para gestionar una mejora).
El otro aspecto que realmente plantea dificultades a las organizaciones es aplicar un método, lo más efectivo posible, para investigar las causas. Se presta muy poca atención a las causas de investigación en el formulario CAPA o el texto incluido es bastante breve. A menudo, el campo no se ha rellenado. Términos como «Error del proveedor», «Devolución», «Reparado» u otros que no tienen nada que ver con el Análisis de Causa Raíz o son tan vagos y escritos apresuradamente que no se puede entender lo que realmente causó el problema. Por cierto, el «Error del proveedor» no es suficiente para una investigación de las causas, es necesario ir más allá y contactar directamente al proveedor para averiguar por qué estaba equivocado.
Entonces, veamos cómo facilitar una investigación efectiva de las causas en 5 pasos.
- Analizar el problema, definir el impacto que tuvo en la calidad del producto y en la efectividad del proceso, así como la estimación en términos de gravedad y probabilidad de ocurrencia (o repetición). Aplicar un proceso de gestión de riesgos;
- Definir un método para identificar la causa raíz o, al menos, la más probable. Por ejemplo, con la regla de los 5 porqués, una sucesión de cinco preguntas que permiten ir al fondo del problema. Ejemplo:
(primero porqué) – ¿Por qué el equipo X en la línea Y en producción no funciona?
(segundo porqué) – ¿Por qué el componente Z del equipo X está roto?
(tercero porqué) – ¿Por qué el componente Z no se ha reemplazado durante dos años, aunque el fabricante indicó la necesidad de una sustitución anual?
(cuarto porqué) – ¿Por qué no se realizó el mantenimiento programado?
(quinto porqué, la raíz del problema) – ¿Por qué el personal de mantenimiento ha dimitido y aún no ha sido reemplazado?.
- Identificar de manera simple la causa raíz. Los inspectores de la FDA y los estadounidenses en general siempre han preferido la lista de control. La biblia en este caso es The Checklist Manifesto: How To Get Things Right de Atul Gawande, una colección de consejos preciosos, tan banales que resulta bastante fácil aplicarlos;
- Describir en detalle la investigación, para que quien no esté dentro de mi cabeza pueda reconstruir el razonamiento llevado a cabo en los puntos 1 y 2;
- Si no se lleva a cabo una investigación, se deberá explicar por qué, proporcionando una justificación sobre la base de criterios objetivos (la investigación ya se ha realizado en la no conformidad/queja vinculada No. x, se encuentra en un porcentaje de defecto históricamente aceptado y documentado, etc.).
Las CAPAs son esenciales para la evolución de la organización y, como ya se ha mencionado, si no son suficientes o no se administran adecuadamente, si se les descuida o están mal direccionadas, el sistema está muerto o está muriendo.
Sin embargo, este es un principio básico que tal vez se olvida en su esencia y que a veces los inspectores de la FDA tienden a recordar. Un principio que va más allá de los tecnicismos de la calidad y que nos devuelve a la vida, a la infancia. Como nuestro proceso de crecimiento desde la infancia hasta la adultez que nos permite evolucionar aprendiendo de nuestro errores.
 Marisa Testa
Marisa Testa
QA/RA Manager
¿Quieres estar siempre al día de las actividades de Thema? Suscríbete a nuestro boletín de noticias!



