El 24 de marzo de 2025 marca un hito para la industria de los productos sanitarios en Australia: en esta fecha entró oficialmente en vigor el sistema de Identificación Única de Productos Sanitarios (UDI, por sus siglas en inglés), tal y como se establece en el Reglamento Therapeutic Goods Legislation Amendment (Australian Unique Device Identification Database and Other Measures) Regulations 2025. Con la introducción del UDI, Australia refuerza su marco normativo, poniéndolo en consonancia con las normas internacionales.
Este cambio tendrá sin duda una importante repercusión positiva en la trazabilidad, la seguridad y la gestión posterior a la comercialización de los productos sanitarios.
En esta primera fase, el sistema UDI para productos sanitarios en Australia es voluntario. En otras palabras, los patrocinadores y fabricantes ya pueden registrarse y cargar datos en la base de datos nacional, la Australian Unique Device Identification Database (AusUDID), gestionada por la Therapeutic Goods Administration (TGA).
En cambio, la introducción de requisitos de etiquetado obligatorios para los productos sanitarios será gradual. La primera fecha límite está fijada para el 1 de julio de 2026: a partir de esta fecha los patrocinadores y fabricantes que distribuyan la mayoría de los productos sanitarios en Australia deberán colocar el UDI en la etiqueta del producto y en todos los envases pertinentes, así como presentar los datos a AusUDID.
Requisitos UDI
La TGA modificó los principios esenciales del anexo 1 de los Therapeutic Goods (Medical Devices) Regulations 2002 para integrar los requisitos de UDI. Al igual que en otros países, el sistema UDI australiano ofrece:
- Asignación de un código UDI (UDI-DI y UDI-PI) para cada producto sanitario.
- Registro de datos UDI en la base de datos AusUDID;
- Inserción del código UDI en la etiqueta y el envase
- Marcado directo para algunos dispositivos reutilizables.
Además, se utilizarán dos formatos complementarios:
- HRI (interpretación legible por el ser humano)
- AIDC (captura automática de datos)
Gracias a este modo dual, la trazabilidad se garantiza tanto manualmente como con sistemas automatizados a lo largo de toda la cadena de suministro.
Aplicación gradual: plazos para los productos sanitarios
El UDI obligatorio seguirá un calendario escalonado basado en la clasificación de riesgo del producto.
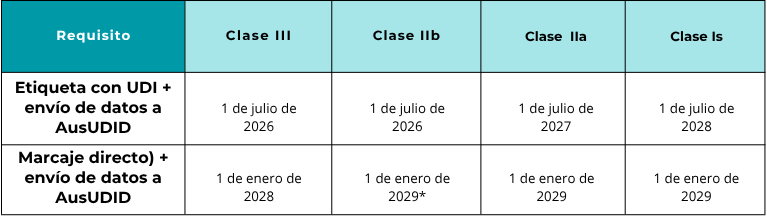
El marcado directo para los productos de la clase IIb puede estar sujeto a excepciones específicas indicadas por la TGA.
Envío de datos UDI a la base de datos TGA
La introducción del sistema UDI en Australia forma parte de un proceso de armonización mundial más amplio en el que participan cada vez más países del sector de los productos sanitarios. El objetivo es hacer más eficaz y transparente todo el ciclo de vida del producto, empezando por su trazabilidad, elemento clave para una gestión responsable y segura. Al mismo tiempo, el sistema UDI contribuye a mejorar la seguridad de los pacientes al facilitar una intervención rápida en caso de problemas, como retiradas del mercado o alertas de seguridad , y apoyar un seguimiento posterior a la comercialización más estructurado y oportuno.
En este contexto, es crucial que patrocinadores y fabricantes empiecen a prepararse desde el principio. Establecer un plan de cumplimiento por fases, actualizar los procedimientos internos y familiarizarse con el funcionamiento de la base de datos AusUDID son pasos necesarios para garantizar una transición fluida y el pleno cumplimiento de los requisitos normativos australianos.
>>> Thema ofrece un apoyo completo para el registro de productos sanitarios en Australia, incluida la conformidad con UDI. Los consultores de Thema le guiarán en cada paso del camino, garantizando una transición fluida y el cumplimiento de la normativa australiana.
FUENTES:
16/06/2025




